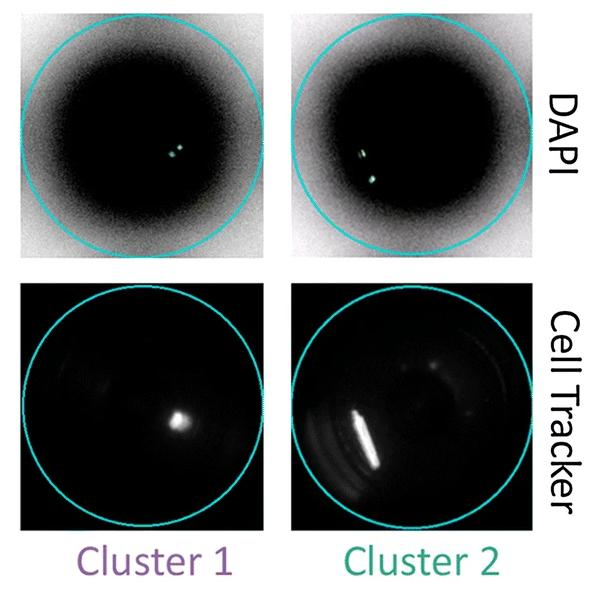
免提核!心肌细胞单细胞测序终破局:细胞高活分选+全转录组捕获
前言:
心血管疾病是全球首要致死原因之一。要深入理解疾病机制和治疗策略,必须先搞清健康心脏的分子运作机制;因此,掌握心脏细胞全谱系及其基因表达图谱,正是实现这一目标的基础性工作[1]。
人类心脏内约有20亿至30亿个心肌细胞,约占心脏总细胞数的四分之一[2][3],因此研究心肌细胞为研究心脏领域的重中之重。但是心肌细胞作为一类特殊的细胞,其高效分离及单个细胞分选是进行单细胞测序研究的主要难点。难以高效分离原因在于这些细胞一旦脱离富含氧气的原生环境便会迅速死亡[4]。难以单个细胞分选的原因,一是该细胞尺寸较大,一般为100μm左右[5],而传统单细胞测序仪器,如10X Genomics平台,其细胞分选口径约40μm,因此不得不对心肌细胞进行提核处理。众所周知,相比于完整细胞测序,提核测序检测到的基因较少(只能检测细胞核中的mRNA,缺失了细胞质中的mRNA信息,与完整细胞的表达谱存在差异);二是该细胞结构脆弱,若分选过程中操作不当,易造成细胞受损破裂,影响数据质量。

针对心肌细胞高质量分离提取的问题

图1:成人心肌细胞分离试剂盒。图源:百洋智心
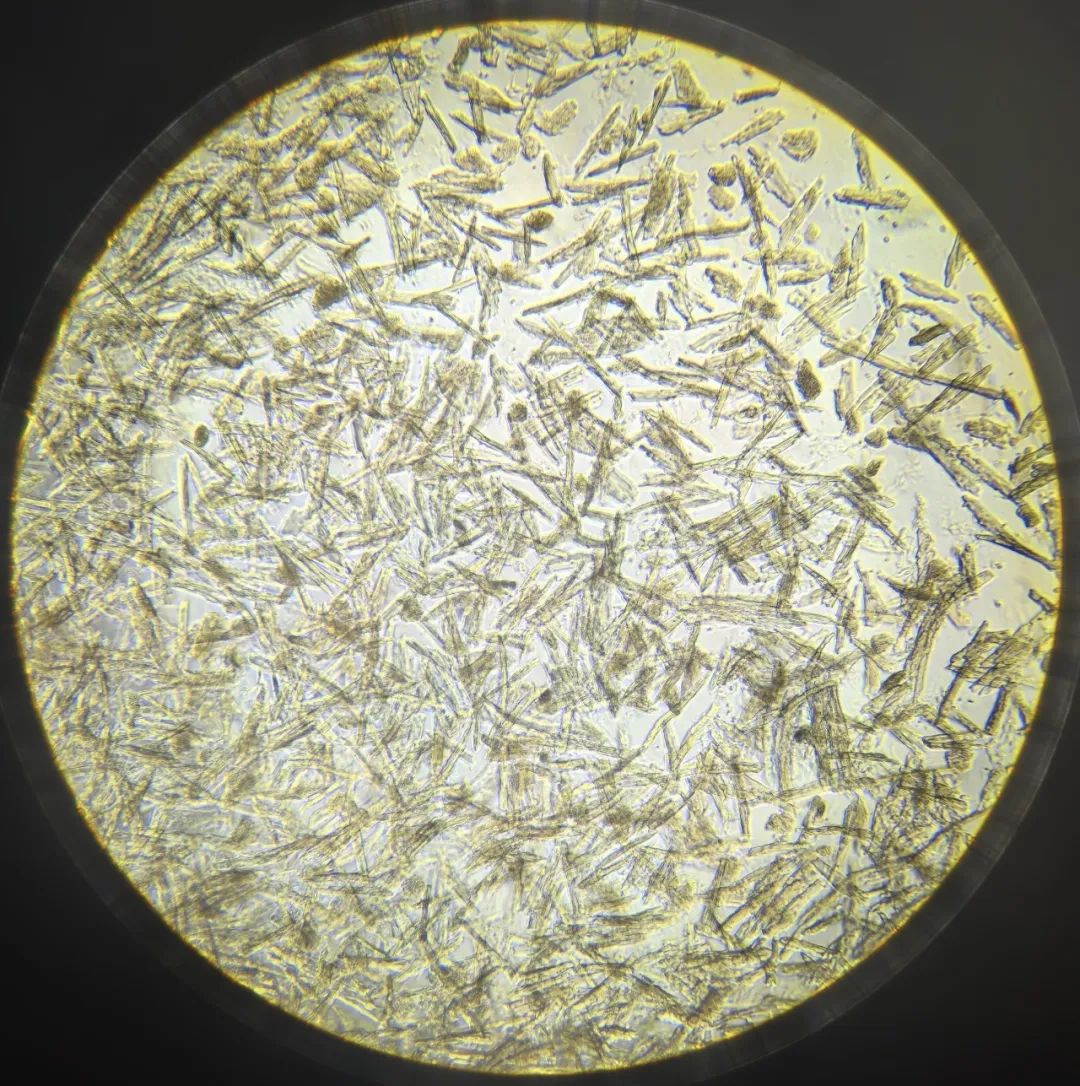
图2:成年小鼠心肌细胞。图源:百洋智心
针对心肌细胞难以单个细胞分选的问题
我们使用ICELL8cx系统(如图3),是一款独特的、基于微孔芯片成像和纳米分液技术的自动化单细胞分离与处理平台。
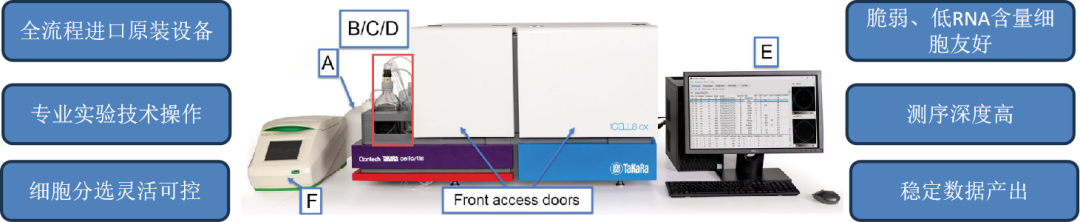
图3:ICELL8cx系统。图源:百洋智心
研究案例分享
欢迎扫码或者在微信服务号后台直接咨询:

—END—
参考文献:
[1] Tirziu, Daniela, Frank J. Giordano, and Michael Simons. "Cell communications in the heart." Circulation 122.9 (2010): 928-937.
[2] Litviňuková, Monika, et al. "Cells of the adult human heart." Nature 588.7838 (2020): 466-472
[3] 梁春宝,李立林,蔡冬青.单细胞核测序揭示成年小鼠心脏构成细胞的分群及占比[J].暨南大学学报(自然科学与医学版),2023,44(02):124-136.
[4] Wang, L. I., et al. "Single-cell reconstruction of the adult human heart during heart failure and recovery reveals the cellular landscape underlying cardiac function." Nature cell biology 22.1 (2020): 108-119.
[5] Woodcock EA, Matkovich SJ. Cardiomyocytes structure, function and associated pathologies. Int J Biochem Cell Biol. 2005 Sep;37(9):1746-51.
[6] Yekelchyk, Michail, et al. "Mono-and multi-nucleated ventricular cardiomyocytes constitute a transcriptionally homogenous cell population." Basic research in cardiology 114.5 (2019): 36.
本篇文章来源于微信公众号:百洋智心