单细胞测序技术“解码”心脏成熟!Cell子刊揭示RNA剪接调控新机制,NCBP2成关键靶点
点击蓝字 关注我们


前言介绍


心力衰竭已成为全球心血管疾病的沉重负担[1],而心脏出生后的成熟过程对维持正常功能至关重要。长期以来,人们对心脏成熟调控机制的认知多聚焦于单一细胞或通路,缺乏全器官层面的系统解析。一项发表在Developmental Cell期刊上题为RNA splicing controls organ-wide maturation of postnatal heart in mice的研究,通过单细胞RNA测序技术,首次揭示了RNA剪接在小鼠心脏出生后全器官成熟中的关键调控作用,为心脏发育和再生研究带来重大突破!

图1 论文题目及作者


研究背景:心脏成熟机制的“未解之谜”


哺乳动物出生后,心脏需经历从胚胎型到成熟型的剧烈转变,包括细胞结构重塑、代谢模式切换及功能完善[2]。此前研究多聚焦于心肌细胞的成熟调控,却忽视了成纤维细胞、内皮细胞等非心肌细胞的作用,且缺乏对全器官层面统一调控机制的解析。
RNA选择性剪接(AS)作为基因表达调控的核心机制,在人类约90%-95% 的基因都会发生[3]。AS与心脏发育和疾病相关,但不同心脏细胞是否存在统一AS 调控程序仍是未解之谜。此研究正是瞄准这一科学空白,展开深入探索。


技术突破:捕获31490个细胞,绘制心脏成熟“全景图谱”


研究团队首先采用ICELL8单细胞测序平台(Takara Bio Japan),对小鼠出生后的关键阶段(P1-P7、P10、P14、P28)及胚胎期(E18.5)的心脏组织进行分析,构建了高分辨率的单细胞转录组图谱。
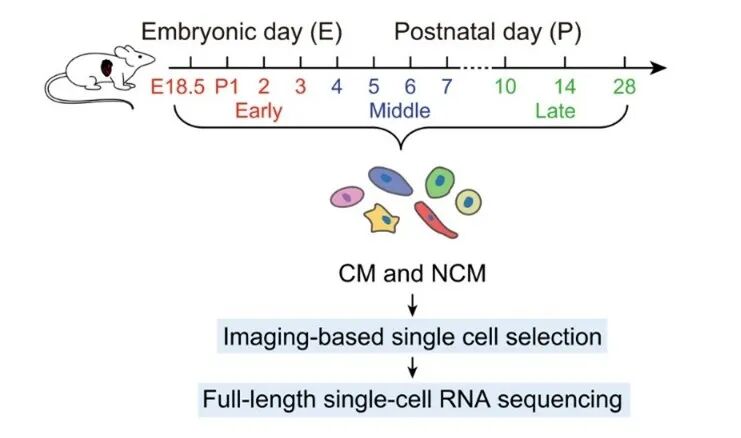
图2 scRNA-seq实验设计和样品收集策略示意图
研究团队将心脏发育划分为三个阶段:早期(E18.5、P1-P3)、中期(P4-P7)和晚期(P10、P14、P28),并最终筛选出31490个高质量细胞用于后续分析。这些细胞鉴定为12种主要细胞类型,包括心肌细胞(CM)、内皮细胞(EC)、成纤维细胞(FB)和巨噬细胞(MP)等,每个细胞平均测序深度达60万条读数,可检测基因3949个,严格的质量控制确保了数据可靠性。
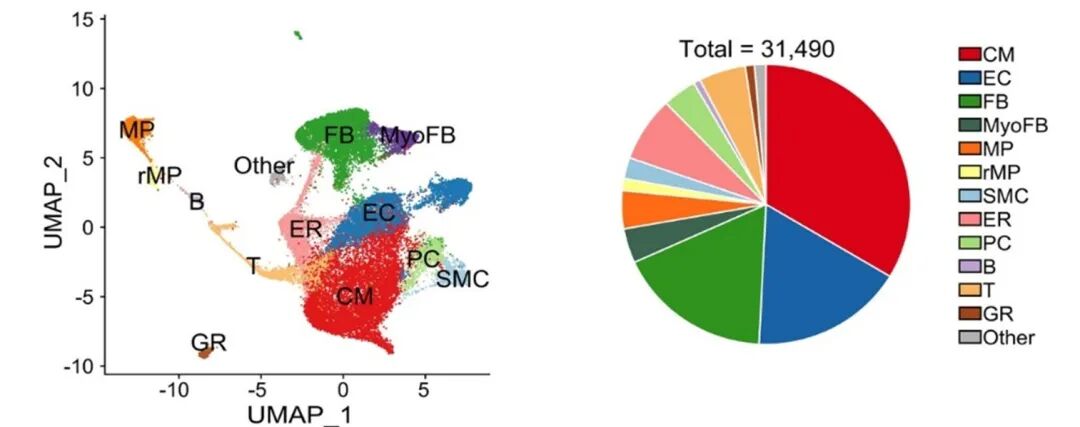
图3 细胞聚类和类型分布图


核心发现一:细胞互作“动态重塑”,FGF信号成“保护屏障”


细胞间通讯分析揭示,不同阶段细胞互作模式差异显著:
早期→中期:心肌细胞与免疫细胞互作显著增强(占上调互作的23.56%和79.73%),血管细胞互作减弱(占下调互作的80.88%),提示出生后初期,免疫细胞可能参与心脏“启动成熟”;
中期→晚期:血管细胞互作增加(占上调互作的74.83%),免疫细胞互作减少(占下调互作的66.21%),表明血管网络重构是晚期成熟的核心事件。
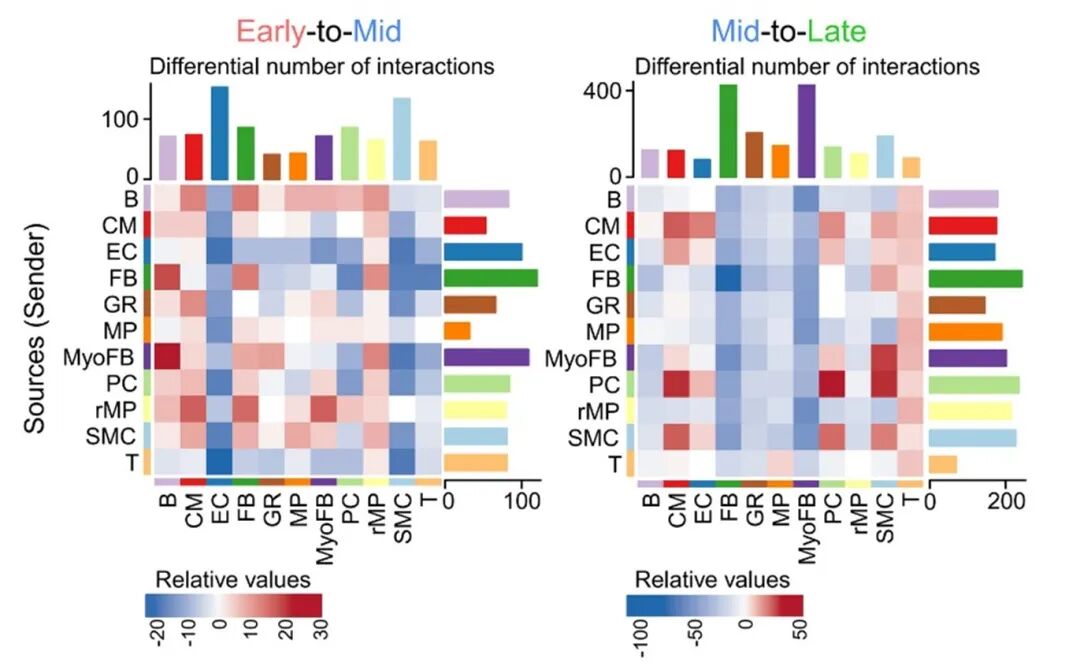
图4 细胞间相互作用在所有细胞类型中的变化
信号通路研究显示,胚胎心脏发育的关键通路Notch信号随心脏成熟逐渐减弱,而成纤维细胞生长因子(FGF)信号持续增强,成为维持心脏稳态的“保护屏障”,这一发现为理解心脏成熟的信号调控网络提供了关键线索。
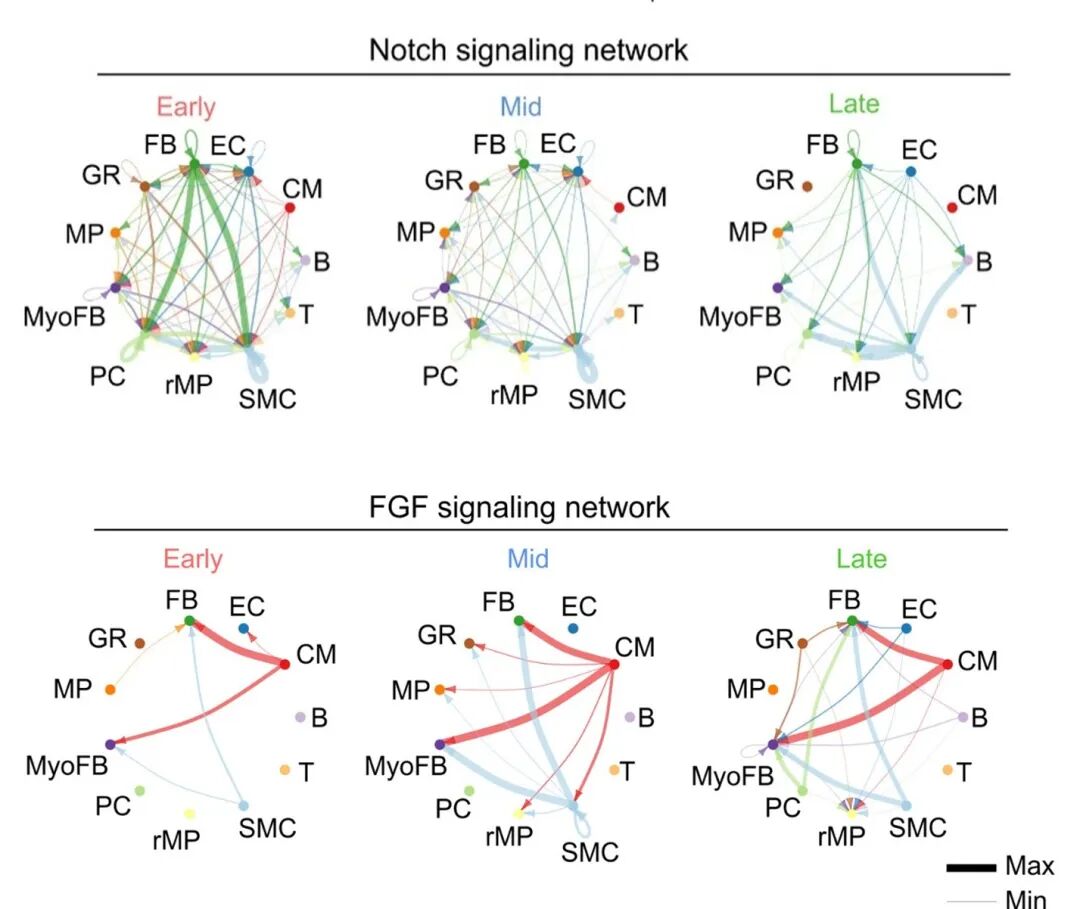
图5 心脏发育过程中不同阶段的Notch和FGF信号通路


核心发现二:RNA选择性剪接是心脏成熟的“分子时钟”


为了探究RNA剪接的作用,研究团队对6210个AS事件进行分析发现,外显子跳跃(SE)是最主要的AS类型(占比54.6%),随后聚焦SE事件展开研究。
与胚胎期(E18.5)相比,出生后P1期SE状态发生显著重构,第一周末(P7)相对稳定,P10-P28再次显著变化;而基因表达呈渐进式变化,与AS图谱动态存在明显差异,提示AS更灵敏反映成熟阶段。
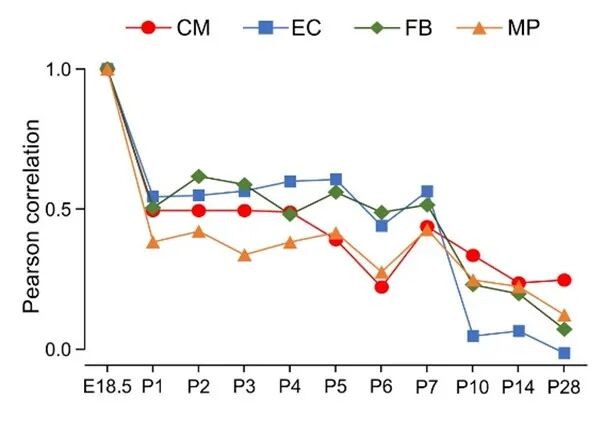
图6 不同时间点每种细胞PSI值的Pearson相关系数
基于SE事件的PSI值(剪接纳入百分比)进行聚类,细胞按发育阶段清晰分组;基于差异表达基因(DEG)聚类,细胞则按类型分组。UMAP分析进一步证实,SE图谱能明确区分不同发育时间点,而基因表达图谱无法实现。
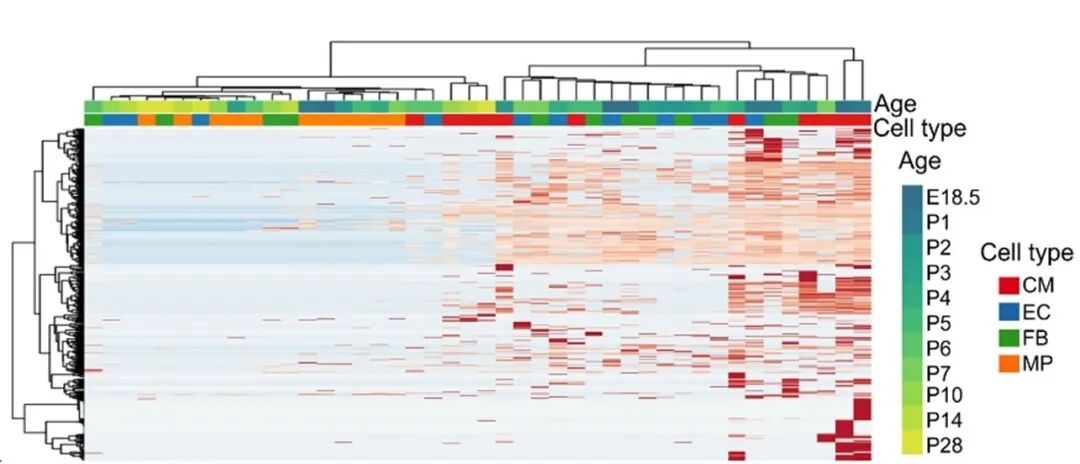
图7 不同时间点主要细胞类型中差异SE事件PSI值的细胞无监督分层聚类
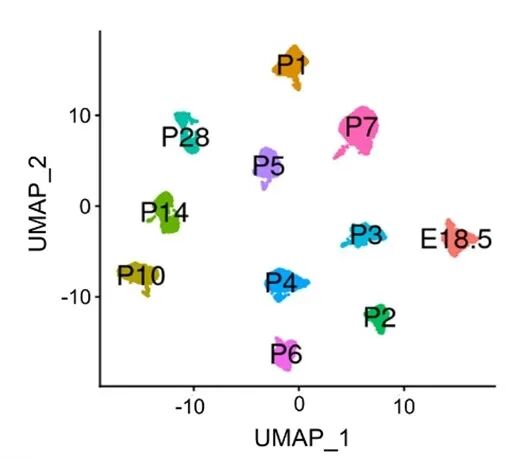
图8 UMAP通过剪接事件的PSI值可视化细胞聚类
通过RT-PCR验证,Luc7l(参与肌生成的剪接因子)随成熟外显子2跳跃增加,PSI值降低;甲状腺激素受体相关蛋白3(Thrap3,一种RNA结合蛋白)随着成熟外显子11-12纳入增加,PSI值升高,与测序结果完全一致。
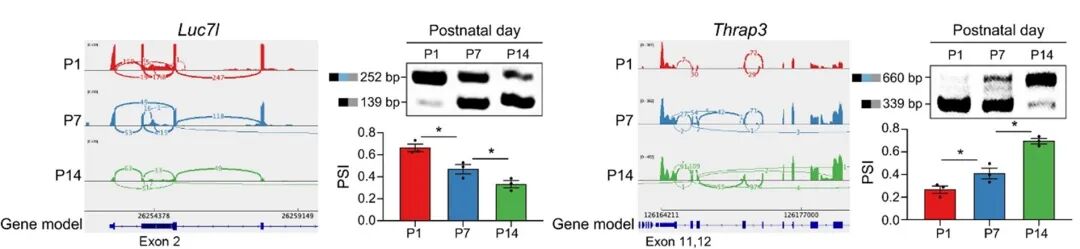
图9 Luc7l和Thrap3的密度变化及RT-PCR验证


核心发现三:RNA结合蛋白NCBP2是心脏成熟的“关键刹车”


RNA剪接由RNA结合蛋白(RBP)调控。研究团队通过motif富集分析和差异表达分析,筛选出69个核心RBP,其中核帽结合蛋白亚基2(NCBP2)表现突出,进一步验证其在心脏成熟中的功能。
在新生心肌细胞中敲低NCBP2能显著抑制细胞增殖,增加肌原纤维束宽度和肌节长度,改善电生理功能(如缩短动作电位时程、提高去极化速度),促进心肌细胞结构和功能成熟。而在成年心肌细胞中过表达NCBP2,会导致心肌细胞成熟特征部分逆转。

图10 敲低NCBP2促进心肌细胞成熟
RNA-seq分析显示,NCBP2敲低对心肌细胞转录组的影响主要体现在剪接水平而非转录水平。NCBP2敲低的新生心肌细胞,其SE图谱与成年心肌细胞更相似;而NCBP2过表达的成年心肌细胞SE图谱向新生心肌细胞特征偏移。
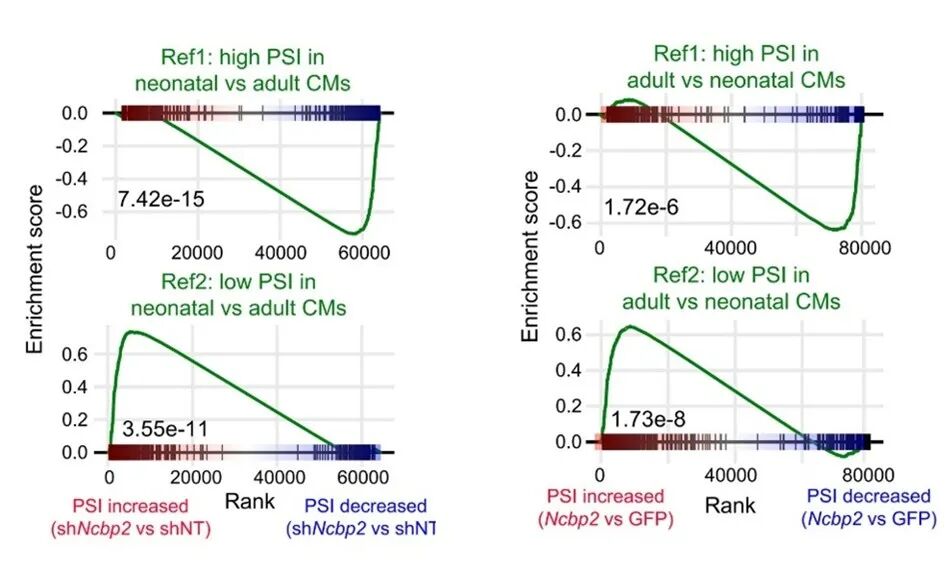
图11 RNA结合蛋白NCBP2通过调节选择性剪接控制心肌细胞成熟
通过CLIP-seq鉴定NCBP2的直接结合靶标,与差异剪接基因(DSG)重叠得到311个(敲低)和239个(过表达)核心靶基因,这些基因富集于肌细胞发育和细胞骨架组织等心脏成熟相关通路。进一步筛选出91个共同靶基因,包括心脏成熟相关基因Ttn、Camk2d等,其剪接模式在NCBP2敲低和过表达时呈相反变化。
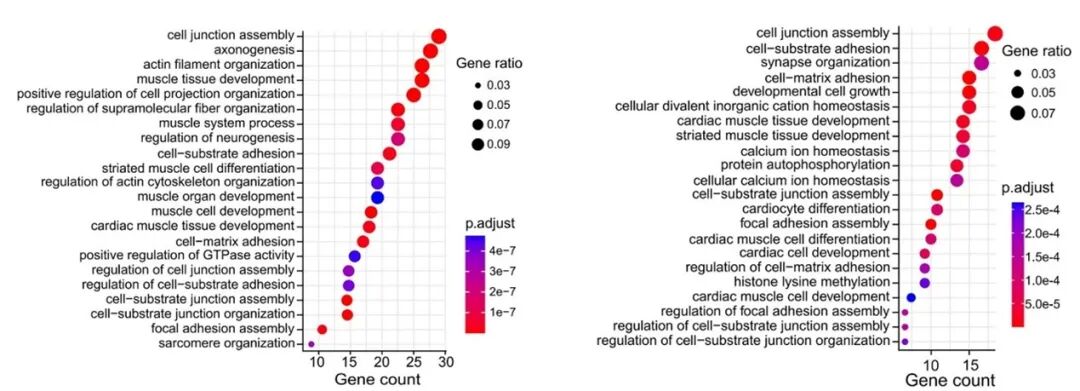
图12 重叠基因的基因功能富集


核心发现四:NCBP2过表达延缓体内心脏成熟


为验证NCBP2在体内的功能,研究团队通过腺相关病毒(AAV)在新生小鼠(P1)心脏中过表达NCBP2,观察心脏成熟过程。
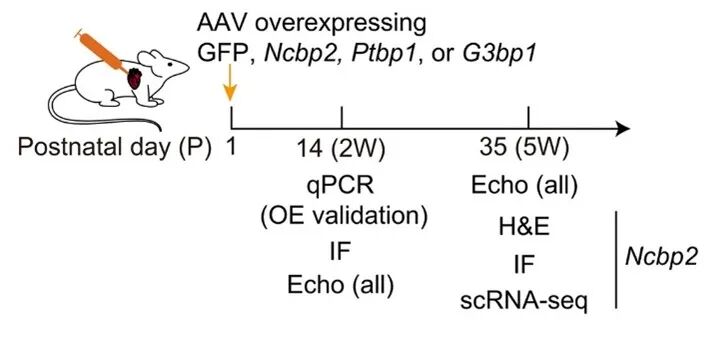
图13 动物实验的工作流程图
NCBP2过表达导致小鼠心脏射血分数(EF)显著升高(2周时由80.26%升至90.36%,5周时由55.38%升高至73.01%),左心室前壁厚度增加,与心脏成熟延迟表型一致。
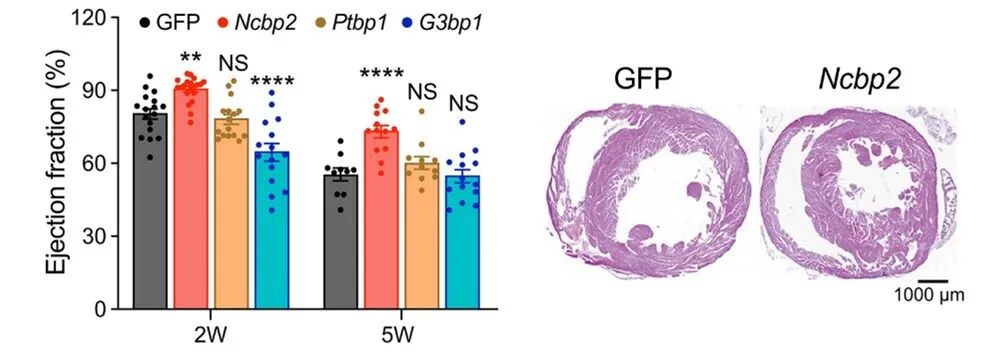
图14 NCBP2过表达导致小鼠早期心脏成熟受到抑制
NCBP2过表达显著增加了心肌细胞增殖标志物(MKI67、AURKB)的阳性率;成纤维细胞早期标志物(FABP4)表达增加,晚期标志物(EGR1)表达减少,表明多种心脏细胞成熟受阻。
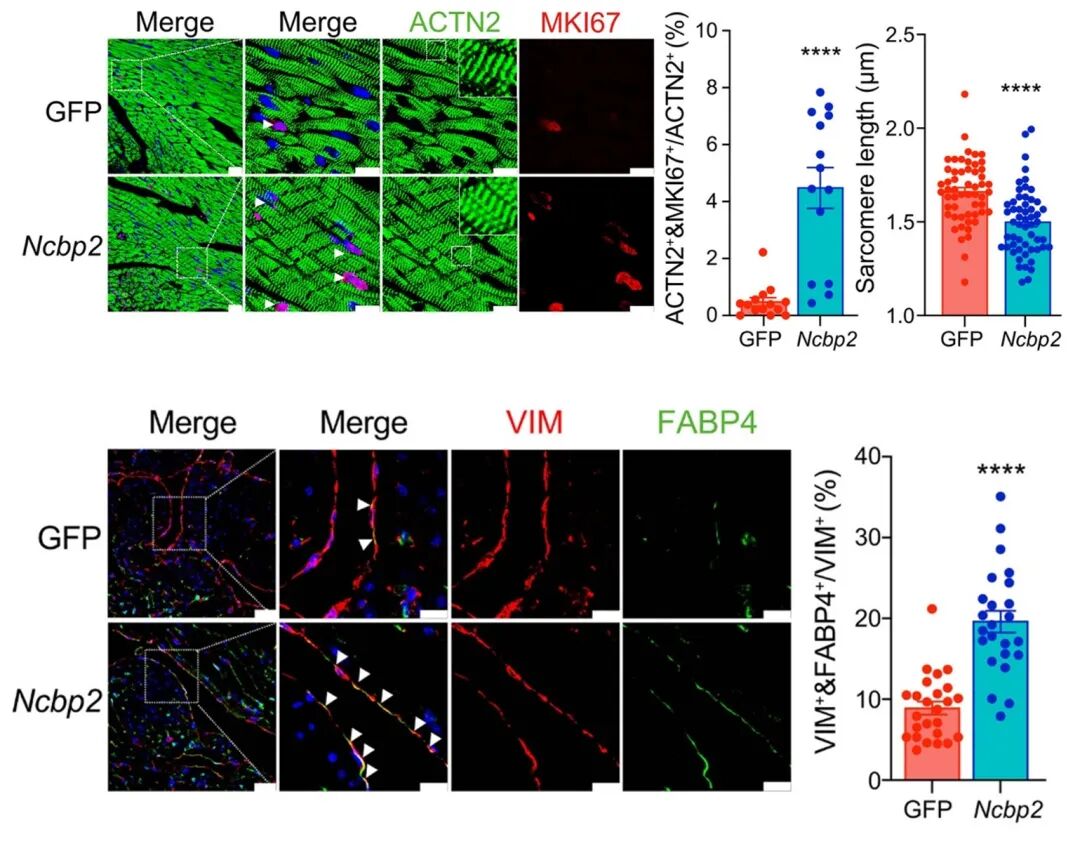
图15 NCBP2过表达导致小鼠多种心肌细胞成熟受到抑制
NCBP2过表达导致129个配体-受体对上调,88个下调,其中94.4%的优势信号通路为早期和中期特异性通路,维持未成熟的细胞通讯模式。
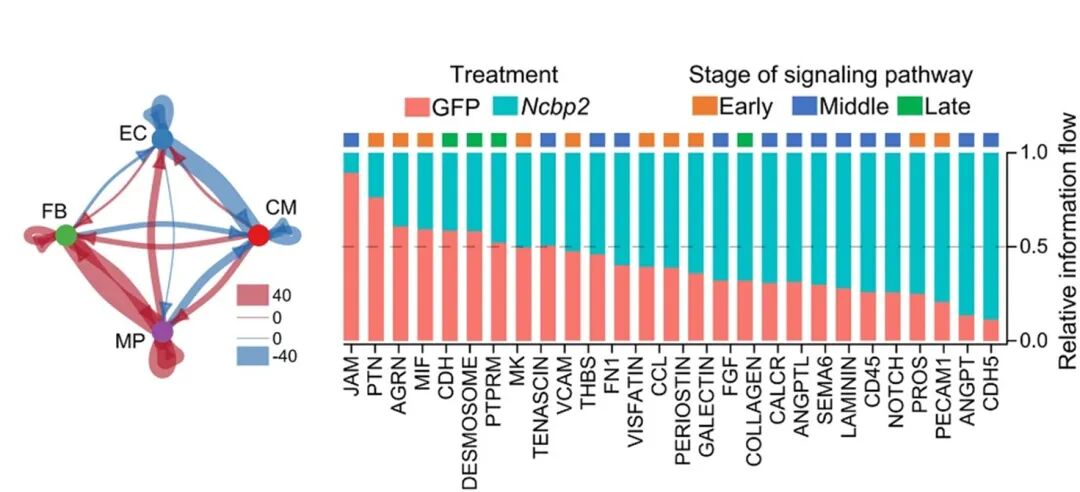
图16 NCBP2过表达后四种细胞类型中细胞相互作用和信号通路变化
此项研究首次从全器官、单细胞、转录本异构体层面,证实RNA剪接是心脏成熟的“统一调控机制”,NCBP2等RBP通过调控剪接,协调心肌细胞与非心肌细胞共同完成成熟过程。这一发现不仅填补了心脏成熟调控机制的空白,更为心力衰竭的治疗提供了精准靶向的新思路,为心血管疾病患者带来新希望!


关于百洋智心


百洋智心应用ICELL8CX系统,提供专业的单细胞测序技术服务。这是一款基于微孔芯片成像和纳米分液技术的自动化单细胞分离与处理平台,具有样本兼容性广泛、细胞分选精确和多组学分析灵活等优势
图17 ICELL8CX系统 图源:百洋智心
如需了解更多技术细节或合作,欢迎扫码咨询!

咨询热线丨010-60855551

参考文献:
1.Greene, S.J., et al., Worsening Heart Failure: Nomenclature, Epidemiology, and Future Directions: JACC Review Topic of the Week. J Am Coll Cardiol, 2023. 81(4): p. 413-424.
2.Bassat, E., et al., The extracellular matrix protein agrin promotes heart regeneration in mice. Nature, 2017. 547(7662): p. 179-184.
3. Pan, Q., et al., Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing. Nat Genet, 2008. 40(12): p. 1413-5.
 往期精选
往期精选
本篇文章来源于微信公众号:百洋智心




